滨州企业优惠政策
-
工业用地
现成工业用地,配套完善,
拿地即开工 -
厂房写字楼
交通便利,价格优惠,
面积可分割 -
产业政策
电子、设备、新能源、
新材料...全产业链政策咨询 -
招商引资
高新技术、注册公司...
扶持企业投资兴业!
在线了解企业优惠政策详情


山东滨州优惠政策
更多政策山东滨州产业园区

 山东-滨州-滨城区
山东-滨州-滨城区

 山东-滨州-滨城区
山东-滨州-滨城区

 山东-滨州-滨城区
山东-滨州-滨城区

 山东-滨州-滨城区
山东-滨州-滨城区

 山东-滨州-博兴县
山东-滨州-博兴县

 山东-滨州-沾化区
山东-滨州-沾化区
山东滨州招商引资
招商政策
投资流程
土地招拍挂
厂房价格
注册公司
优惠政策
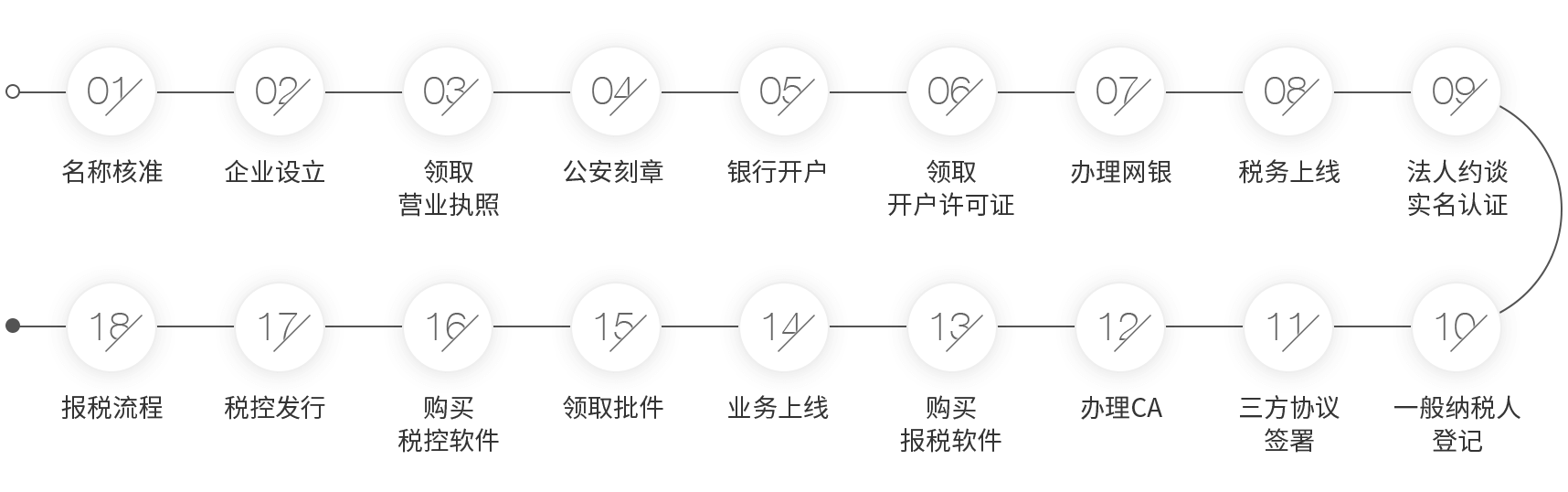
山东滨州投资流程






免费获取政策汇编